3、利用注射器等医用材料的微型实验
活动1 注射器用于加样
【实验原理】
注射器带有刻度,可以比较直观地读出盛有的液体或气体的体积,而且控制起来比较容易,常用于向体系中加入试剂。在本实验选择的实验活动中,注射器所起到的作用不尽相同。
【实验用品】
仪器和装置
注射器、青霉素瓶、具支试管、气球、微型燃烧匙、试管、酒精灯
试剂和材料
氯气、钠、硫粉、NaOH、浓氨水
【实验过程】
1.钠与氯气反应
(1)用注射器(50 mL或20 mL,“玻璃”注射器更 佳)在实验室吸取纯净、干燥氯气。
(2)取黄豆粒大的钠(吸干煤油,去氧化膜),置于 小号具支试管中,将试管直立固定。将注射器与具支
试管连接好。
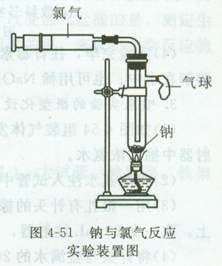
(3)加热试管,在钠熔化成银白色闪亮小球时,撤 去酒精灯。
(4)推压注射器,使氯气进入试管,钠燃烧,火焰 呈黄色,有浓浓的白烟;停止推注射器,则燃烧停止 ;再推,钠又燃烧。反应后,管底、管壁附着白色粉 末——氯化钠。
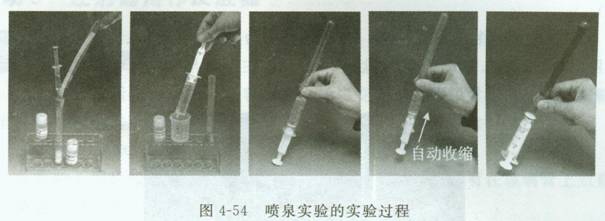
2.喷泉实验的微型化设计
(1)如图4-54组装气体发生装置,向试管中加入NaOH固体,向2 mL注射器中抽入浓氨水。
(2)将浓氨水注入试管中,生成氨气,用向下排空气法收集1试管氨气。
(3)用一根扎有针头的橡胶塞迅速塞在充有氨气的试管口,倒置于试管架上。取一支20 mL注射器,抽满水(滴入几滴酚酞溶液)。
(4)将针头与盛满水的20 mL注射器连接。压注射器的活塞,将少量水注入试管中。之后注射器中的水便迅速涌入试管,形成美丽的喷泉。
(5)制气装置的处理:堵住出气口的针头帽,将盛有20 mL水的注射器与之连接,注入几滴水后,注射器中的水便自动被压入试管中,达到稀释溶液、吸收氨气和清洗试管的作用。
【实验过程】
在以上2个小实验中,注射器分别起到了什么作用?相应的常规仪器是什么?使用注射器作为替代仪器有哪些优势?
活动2 注射器用作量具
【实验原理】
利用注射器的刻度可以读取液体或气体的体积,并能够换算出相应的物质的量,从而可以进行定量实验。本实验以“化学反应各物质之间的定量关系”为题材,利用镁带与盐酸反应,保持镁带的量不变,改变加入盐酸的量,测定生成的氢气的体积,通过盐酸的用量和氢气体积之间的关系,来探讨化学反应物质之间的定量关系。
【实验用品】
仪器和装置
1 mL注射器(含针头)、50 mL注射器(含针头)、大试管、橡胶塞、铁架台与铁夹、天平及砝码、剪刀、砂纸、直尺
试剂和材料
6 mol/L盐酸、镁带
【实验过程】
1.将镁带打磨光亮后,放到天平上称量,通过改变镁带的根数或逐渐剪短镁带的长度,调整其总质量为0.5 g。
2.用直尺测量镁带的总长度(L1),截取该镁带长度的1/12备用(长度为L2)。
3.组装实验装置如图4-55,将一段长度为L2的镁带投入试管中,1 mL注射器中抽取1 mL mol/L盐酸,50 mL注射器活塞处于0刻度,塞紧橡胶塞。

4.向试管中注入0.1 mL盐酸,待无气泡放出时,读取大注射器所示气体体积,并记录到表格中。同样,继续向试管中注入盐酸,每注入0.1 mL,读取1次体积,并记录。
5.一边滴加盐酸,一边注意观察实验现象,当镁带消耗完全时记录所用盐酸的体积。继续向试管中注入盐酸,并记录对应的气体体积,直至盐酸滴加完全。
6.以消耗盐酸的体积为横轴,以生成气体的体积为纵轴,将记录的数据点标在坐标系中。绘制数据变化趋势线,斜线和水平线的交点表示恰好反应时消耗盐酸的体积以及生成气体的体积。计算反应体系各物质物质的量之比。
【实验讨论】
1.本实验中用到的两支注射器分别起到什么作用?这对注射器的性能有哪些要求?
2.分析本实验的误差来源,以及需要注意的问题。
活动3 注射器用作反应器
【实验原理】
由于注射器活塞可伸缩,其容积能够发生变化,因此注射器用作反应器时可借助活塞控制排除空气的干扰,以下举出的案例体现了注射器这一优势。
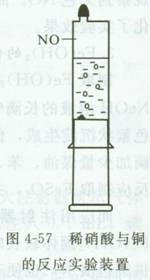
2.稀硝酸与铜的反应
由于NO易与O2发生反应,所以在普通试管中做演示实验时,学生很难观察到无色NO。而使用注射器进行该实验就可以排除容器内的空气,从而强化了实验效果。
3.Fe(OH)2的制备
制取Fe(OH)2的传统方法是在试管中加人一定量的FeSO4溶液,将吸有NaOH溶液的长滴管伸入到FeSO4液面以下,小心滴加溶液。虽然能观察到白色絮状沉淀生成,但是瞬间就变成灰绿色、红褐色。后来有人在FeSO4液面上滴加少量煤油、苯、石蜡作为保护层。也有人在试管中临时用铁粉和硫酸溶液反应制取FeSO4,并利用产生的H2驱除试管内的空气,然而效果都不理想。
而应用注射器可以很好地起到排除空气干扰的作用,可以使制得的Fe(OH)2固体较长时间保持白色。该装置小巧,操作简单、易控,便于教师边讲解边演示,也便于学生传阅观察或同步操作。
 |
【实验用品】
仪器和装置
注射器及针头、橡胶塞
试剂和材料
铜片、稀硝酸、FeSO4溶液、NaOH溶液
【实验过程】
1.稀硝酸与铜的反应
(1)向针筒内放人一小块铜片,推入活塞。
(2)吸取所需量的稀硝酸,排出气泡,并迅速用塑料帽套牢 尖嘴,且使尖嘴向上。过一会儿,可观察到活塞缓慢外移,同 时针筒内出现了无色气体。
(3)为了验证针筒内的气体是NO,可以拔去塑料帽。然后 向外拉出活塞,吸入一些空气,针筒内气体立刻变成了红棕色。
2.Fe(OH)2的制备
(1)选择透明度好的注射器吸取FeSO4溶液,排出针筒内的 气泡。
(2)继续用注射器针头吸取NaOH溶液,勿使空气进入,立 即可观察到白色絮状沉淀生成,迅速将针头插入备用的胶塞内 密封,可长时间保存之。
(3)当需要观察氧化过程时,再取掉胶塞,吸入空气,变化立刻发生。
【实验讨论】
1.上述2个实验设计各有什么优点?分别利用了注射器的哪些功能特点?
2.总结讨论注射器等医用材料在实验设计中的应用途径,并尝试利用注射器进行微型实验设计。
附:其他仪器和用品在微型实验中的应用
微型实验的设计不拘泥于使用某些特定的仪器,可选取各种材料进行实验设计,只要起到药品用量少、实验现象效果明显即可,可谓实验设计无定法,节约环保是目的。接下来再举一些微型实验设计的优秀实例,供大家参考,以启发思路。
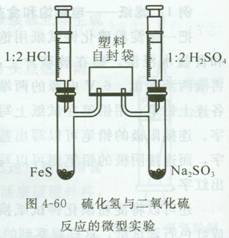
例1 塑料自封袋——硫化氢与二氧化硫的反应
同时制取硫化氢与二氧化硫,均通人塑料自封袋中,待袋子鼓胀后,可停止制取气体,再将两导管拔出转插入稀碱液以消除尾气,袋口压实可拿下来让学生观察,片刻可见塑料袋里形成一层淡黄色的固体硫。清理时,向袋内注入碱液吸收。
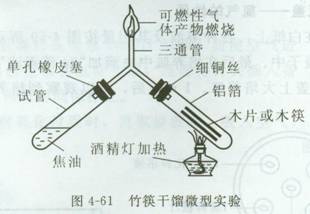
例2 铝箔——竹筷干馏实验
用铝箔纸折成试管的形状后,将木片或竹筷子放入铝箔试管中。再将铝箔纸试管管
口套在三通管右管之单孔橡皮塞上,用细铜丝将其绑紧。
用酒精灯在铝箔试管下方加热。加热几分钟后,发现有白色烟雾由三通管上方逸出,用点燃的火柴靠近白烟,白烟能够燃烧。
干馏所产生的焦油,会经由三通管进入塑料小试管中收集起来,而干馏后转变成的木炭则留在铝箔试管中。
例3 滴瓶——铜与浓硝酸反应
取一只无色滴瓶,内盛有适量的蒸馏水,用镊子夹取一小块铜片于滴管中,吸取浓硝酸后,将滴管插入瓶中。此时可观察到铜片表面产生大量的气泡,滴管中溶液逐渐变为绿色,液面上方产生红棕色气体。然后滴管中的液体被压入瓶内,瓶中溶液变为蓝色;一会儿瓶中溶液又缓缓回升到滴管中,气体颜色逐渐变浅直至无色。