|
一.球碳的发现
碳有几种同素异形体 在自然界中,碳元素可以说是多姿多态的,但从分类上来说,主要有两大类,一类是晶形碳(简称晶碳);另一类是无定形碳。晶碳中的碳原子按照一定的规律排列成为有序的晶体形式,例如金刚石和石墨中的碳原子都排列有序,它们都属于晶碳。在无定形碳中,碳原子的排列方式是无规则的,它们呈现出一种无序的无定形的形式。
1985年,球碳(C60)的发现开始在化学界激起千层浪。
1985年,英国萨塞克斯大学教授克罗托(H.W.Kroto)、美国赖斯大学教授斯莫利(R.卫.Smalley)和科尔(R.F.Curl,Jr)以及他们的两位研究生[希思(LHeath)和奥布赖恩(S.O’Brien))在英国著名的《自然》杂志上发表论文,宣布他们在赖斯大学的实验室中,利用激光轰击石墨,使石墨中的碳原子气化,然后让气态的碳原子冷却形成固态的碳原子簇,最后用时间飞行质谱仪进行分析,从质谱图上发现了C60和C70。等由偶数个碳原子所形成的一系列的碳原子簇。
这一具有划时代意义的发现以最快的速度在《自然》杂志上发表,《自然》杂志是世界上极有声望的杂志,全世界许多重大的发现(后来有许多发现都获得了诺贝尔奖金)都是首先在这本杂志上发表的。由此可见,C60的发现怎能不引起全球化学界的震动? C60的发现首先改变了碳只有3种同素异形体(金刚石、石墨、无定形碳)的概念,于是,从1985年开始,一些国家的教科书和科技书刊中都将碳只有3种同素异形体这个概念改为碳有4种同素异形体。
C60的发现也引起了许多科学家的反思,像碳这样的在19~20世纪已经被化学家详细研究过了的化学元素,居然在它的基本研究领域中还存在着重大的遗漏,应该引起研究工作者的奋起直追。当然,C60的发现应该在什么时候产生,对于克罗托、斯莫利和科尔来说是偶然的,但是对于科学的发展则是必然的。对于科学界来说,应该负有早日促成这些划时代发现产生的责任,使科学发展的进程更快一些。
另外一个值得反思的问题是,在我国,介绍球碳发现还不够及时。在1985年以后,我国的教科书中还在介绍碳只有金刚石和石墨这两种同素异形体,因此,在我们的课堂上,也迟迟不能出现C60,成为化学教学上的一个空白点。这说明我们在及时跟上时代的步伐和反映科学新发现方面还做得不够,很有必要努力赶上日新月异的科学发展进程。
二.C60的分子结构
1.C60结构的异想天开
研究C60的分子结构究竟从何处下手呢?有哪些经验是可以借鉴的?首先应该考虑的一个问题是,C60与金刚石、石墨同为碳的同素异形体,C60的分子结构会不会与金刚石、石墨相似呢?
金刚石和石墨都是三维网状结构,它们都是一种巨型的大分子。从某种意义上来说,金刚石和石墨都以无限多的碳原子组成。
然而,组成球碳的碳原子只有60个,是一个有限的、确定的数,它是单个有限的碳分子,不是一个大分子,因此,球碳不可能是与金刚石、石墨类似的结构。金刚石的结构从比较这三种同素异形体的稳定性出发,还可以有以下的分析。在金刚石大分子中,分子内部的碳原子与处在分子边缘的碳原子的处境是不同的,在分子内部,每一个碳原子都以共价键与其他四个碳原子相连,它们的结合力已处于饱和状态(因为碳是4价的),不会再与其他原子结合。然而,处在分子边缘的碳原子却不同了,与它们结合的碳原子都少于四个,因此,它们的结合力处于不饱和状态,即处于分子边缘的碳原子还有余力可以与其他原子相结合。一般情况下,原子互相结合时形成的化学键是离子键或共价键,而金刚石或石墨大分子上处于边缘的碳原子所具有的剩余的结合力则称为悬键。
由以上分析,可以认为,具有悬键的原子比不存在悬键的原子要活泼。金刚石虽然被称为极其稳定的宝石,但由于它的分子中存在着悬键,因此,在高温下金刚石仍能与氧气、硝酸钠、碳酸钠、重铬酸钾、硫酸发生化学反应。石墨的化学性质要比金刚石活泼,浓硫酸和浓硝酸的混合物加上氯酸钾能将石墨氧化为石墨的氧化物,它是酸性氧化物,被称为石墨酸。熔化的碱金属也能与石墨化合成MC8、MC24、MC36、MC48(M为碱金属)。
C60与金刚石、石墨不同,C60分子中并不存在悬键,而且是由有限碳原子(60个)组成的小分子,因此,C60决不能是一个大分子,而是一个有限分子。可是,C6。到底是一个什么样的有限分子,它的分子结构的模型究竟怎样,一直使克罗托等人陷入冥思苦想之中。
正当克罗托、斯莫利、科尔等人在热烈讨论C60的分子结构时,克罗托忽然想起了他曾经参观过加拿大蒙特利尔市万国博览会中的美国馆,这是一座外形奇特的穹窿建筑,犹如一个大球。这座建筑物给了克罗托等人很大的启发:“C60是不是一种球形分子?” 从那以后,化学和建筑学这两门科学之间架起了一座金桥,而万国博览会美国馆的设计者富勒与C60也结下了解不开的姻亲。
加拿大蒙特利尔市万国博览会美国馆的设计者是美国建筑师巴克明斯特·富勒(R.BuckminsterFuller)。虽然在20世纪末,由于C60是用他的姓名来命名的,从而使他成为科学界的名人。
值得一提的是,在漫长的科学探索的道路上,“异想天开”常常也是科学的发现和发明的源泉,当然,富勒的异想天开在建筑学上开花结果,这是很自然的。可是,使人未能料想到的是富勒的异想天开还会在建筑学以外的其他领域获得成功,也就是多面体穹窿结构圆满地解决了C60的分子结构问题,这样的异想天开在科学界实属罕见。
还有一点值得介绍,富勒在建筑系讲课时,一直鼓励建筑系的学生学一点化学。他认为,化学中讨论的物质结构是自然界中的自然结构,它是最合理的,也是最完美的结构。现在看来,富勒的这些话存在着深邃的哲理,也使富勒的名字永远与化学这门科学结下了不解之缘。也许富勒永远也不会想到,他在化学界的名气一点也不亚于建筑界,甚至有过之而无不及。因为迄今为止,穹窿建筑物还从来没有以富勒的姓名来命名的,而C60被称为“富勒烯”,C60大家族被称为“富勒烯家族”,它们并未用C60的发现者(克罗托、斯莫利、科尔)的姓名来命名。富勒在建筑学上的发明使他一举成名,而C60的发现更为他带来了不朽的声名,这不能不说是一种奇遇,但这种奇遇却不是偶然的,而是必然的。
2.C60与几何学
富勒的多面体穹窿建筑确实给了克罗托、斯莫利和科尔以很大的启示,可是C60到底是一种什么样的球形的多面体结构,还需要他们进一步思考,特别是利用几何学知识来判析C60的分子结构。
瑞士数学家欧拉(L.Euler)发现,不论是什么形状的凸多面体,其顶点数u、棱边数e与面数f之间总存在着下列数学关系:u-e+f=2。 从这个公式可以证明规则的凸多面体只有5种,即正四面体(4-6+4=2)、正六面体(8-12+6=2)、正八面体(6-12+8=2)、正十二面体(20-30+12=2)和正二十面体(12-30+20=2)。
克罗托等人在确定C60分子结构时,主要依靠的却是科学的分析和推理方法,他们全面地解剖了多面体组成分子的详细过程,发现了一个具有60个顶点的多面体穹窿结构。特别值得一提的是,他们发现只有在规则正二十面体的顶角下的棱长1/3处将顶角削去,才能被平截为一个由20个六边形和12个五边形组成的具有60个顶点的三十二面体穹窿分子,这一点最能体现克罗托等人的聪明才智和创新精神。
其实,富勒确实给予克罗托等人很大的启发,可是,克罗托等人所走过的不平坦的科学道路,他们所做的那些具体的工作也是功不可灭的。应该说,富勒曾经对克罗托等人进行了启蒙:“C60分子可能是球形的多面体结构。”但是按照这个思路踏踏实实走下去的却是克罗托等人,是他们分析了C60分子不存在悬键,是一种有限的分子。是他们找到了与C60分子非常适应的三十二面体结构,还亲手用纸片拼砌成了一个活生生的C60分子,真可谓“功夫不负有心人”。
富勒曾经告诉他的建筑系的学生,要他们多学些化学这门富有对称性的科学。那么,我们作为化学老师,是否也应该告诉我们的学生,要多学些数学知识,多学些几何学。克罗托等人获得成功的秘诀之一就是他们熟悉几何学。我们经常告诉学生要一专多能,扩大知识面,如果你能用克罗托等人的例子来启发学生,那么,这种启迪性岂不是更大吗?
克罗托、斯莫利和科尔最值得我们学习的科学精神又是什么呢?那就是创新精神。
C60属于什么样的分子结构,这在任何一本书中是找不到的,甚至连最简单的启发也都没有。而克罗托等人想到的却是将C60的分子结构与建筑学和几何学联系起来,这首先是一种创新。
下一步,克罗托等人并没有遵循常规的路子,用仪器分析方法来证明他们的科学分析是正确的,而是采用比较原始的费时费力的方法,用多边形纸片拼接成了C60的分子模型,这种原始的方法同样体现了克罗托等人的创新精神。
当然,克罗托等人在后来也使用了仪器分析,测定了分子结构中的各种参数,但那是后来的事情。
由此可见,创新精神的体现不一定要应用现代的科学理论和高精尖的分析方法,克罗托等人利用经典的几何学以及剪刀加浆糊的办法照样能够解决实际问题,而且这样的创新精神应该说更为可贵。
人们常说,诺贝尔科学奖最能体现科学的创新精神,如果要举出具体的例子,克罗托、斯莫利和科尔就是最好的榜样。
3. 一个完美的分子
C60是一个球形三十二面体结构的分子,60个碳原子位于三十二面体的60个顶点上。由三十二面体的图形中,可以看到每一个顶点下只有3条棱边,也就是说,如果C60采用三十二面体结构,每一个碳原子只与其他3个碳原子相连。可是,碳的价键理论已经明白无误地证明,碳原子是4价的。那么,克罗托等人的设想是否违背碳原子4价这一普遍规律呢?化学家对C60分子中的碳原子连接方式又将作出什么样的解释呢?
在19世纪,众多的有机化合物中,苯分子中碳的原子价和结合方式是最令化学家们费解的。德国化学家凯库勒(F.A.Kekule)提出,苯分子是环状结构,在苯环中,每隔一个单键就有一个双键存在。应该说,苯的分子结构对于我们理解和确定C60分子结构中的化学键是有帮助的。
受了凯库勒确定苯环结构的启发,克罗托等人对于C60的分子结构作了进一步的修正。他们认为,在C60分子中,每一个碳原子与其他3个碳原子相连,只用掉了3个原子价,显然,还剩下一个原子价没有被利用。于是,他们模仿凯库勒的处理方法,6个碳原子形成的苯分子中存在着3个双键,那么,由60个碳原子形成的C60分子中一定存在着30个共轭双键,这样就可以圆满地解决了碳原子仍然是4价的问题。
现在,C60分子中存在着30个双键以及那种单键和双键交替出现的结构,已经由红外光谱证实了。由于存在着这样的结构,C60应该和苯一样,具有芳香性,也就是说,C60和苯一样,是一种不饱和分子,可以形成许多衍生物。由于C60分子中的双键是苯分子的10倍,因此,C6。形成的衍生物将比苯还要丰富的多。
C60可以在锂、液氨和正丁醇溶液中进行还原反应,使C60分子中的一部分双键打开,加进氢原子,形成C60H18和C60H36。目前,尚未能使全部(30个)双键打开以形成C60H60。但是预想中的C60H60的分子结构已经有了,化学家们还给它起了一个名称,叫做Fuzzyball。
C60粉末在加热情况下可以被氟分步氟化形成C60F6,C60F42,但还未能氟化为C60F60。另外,还合成了两种更复杂的C60的衍生物,它们是{[(C2H5)3P]2Pt}C60和C60Os04·(四特丁基吡啶),这进一步说明了C60分子上可以加入各种各样的官能团,制备出具有特殊性能(如特殊催化性能)的化合物,大大地丰富了合成化学的内容。
C60分子中碳原子的成键状况与金刚石和石墨也有所不同。碳原子核外共有6个电子,其基态的电子构型是1s22s22p2,其中1s和2s轨道都是填满的,2p轨道未填满,因此,碳原子有2个未配对的电子,从这一点来看,碳原子应该是二价的。事实上,在有机化合物中,碳都是四价的,在金刚石和石墨分子中碳也都是四价的,这是由于碳原子的杂化轨道决定的。 所谓杂化轨道,是指当碳原子在成键时,在基态电子构型1s22s22p1x2p1y中将2s轨道上的一个电子激发到2pz轨道,使碳原子具有新的电子构型ls22s12p1x2p1y2p1z,由这4个轨道(2s12p1x2p1y2p1z)之间重新组成新的轨道便是杂化轨道。在最简单的有机分子甲烷(CH4)中便是以杂化轨道成键的,因此甲烷中的碳原子是四价的。在金刚石分子中,碳原子的杂化轨道也是这样的。
石墨的杂化轨道与金刚石不同,其中的碳原子由一个s轨道(2s轨道)和两个p轨道(2x/和2py轨道)形成sp2杂化轨道,只形成三个共价键,因此在石墨分子的每一层中碳原子只以三个共价键与其他碳原子结合,石墨中未参与杂化的2pz轨道则形成丌电子,将石墨分子的层与层之间结合在一起。
C60的成键状况要比金刚石和石墨复杂。在C60分子中,所有60个碳原子全部是等价的,而且由于球状表面的弯曲效应和五圆环的存在,会引起轨道杂化的改变。与石墨相比,丌电子轨道不再是纯的p轨道电子,而是含有一定的s成分,因此,C60分子的杂化轨道处于石墨的sp2杂化和金刚石的sp3杂化之间。在C60分子中,每个碳原子和周围的3个碳原子以sp2.28杂化形成3个o键,再以s0.09p杂化形成一个丌键。o键沿球面方向,丌电子则分布在球的内外表面,形成球状芳香族分子。
C60分子是球形结构的,由于表面弯曲,影响了杂化轨道的性质,但其中的化学键仍可分为两类——单键和双键。所有形成五边形环的键都是单键,键长为1.46x10-10m。由于C60中有12个五边形,因此分子中一共有60个单键。其余相邻两个六边形环之间的键为双键,键长为1.39X10-10m。C60中一共有30个双键。这种单键和双键交替出现的结构使C60表现了芳香族分子的特性。
4.C60分子对称性与黄金分割律
迄今为止,C60是三维空间可能存在的最对称和最圆的分子,C60的高度对称性使得球面上的碳原子能分摊外部压力,而且十分稳定。由于这一原因,1991年C60被美国《科学》(Science)杂志评选为1991年度的明星分子,原因是C60以一种绝对新颖的结构出现在世界上,化学世界正在热烈欢迎这位具有最美的和高度对称性的新伙伴的到来。
虽然化学家首先从晶体开始,认识了对称性的概念,但是实际上世界大得很,对称性本身是一个美学问题,是一种真善美的体现,地球乃至宇宙中的许多物质无不要遵循对称性最高的原则,例如,太阳、月亮、地球以及许多星球都是圆的,都以讲究对称性而存在。
化学发展到今天,要向纵深发展,必须追求高度的对称性,它不再局限于研究晶体的对称性,而要去开拓分子的对称性研究。
C60是截角二十面体的结构,正二十面体具有五度对称轴,因而C60分子有着显著的对称特征,即五重对称性是C60分子结构的重要本质特征。
五重对称之所以重要,还因为五边形体现了黄金分割律。黄金分割律由著名的菲波那契级数得出,菲波那契级数由o,o!,1开始,以后各数均为其前面相邻两个数之和,即为0,0!,1,2,3,5,8,13,21,34,55,89,……,从1开始,每—个数与其相邻的前一个数之比逐渐趋于一个极限值τ,τ=(√5+1)/2=1.61803,是一个无理数。如果将一个正五边形的对角线连接起来,便可发现,正五边形对角线与其边长之比正好是τ=1.61803…,即黄金分割无理数。因此黄金分割是正五边形的主要性质,二十面体具有五度对称轴,是黄金分割在三维空间的体现,C60分子是截角二十面体结构,具有二十面体性质和五重对称性,因而体现了黄金分割的特征。
黄金分割概念最早是由意大利达·芬奇和德国开普勒提出的。由于著名的古埃及金字塔和印度的泰姬陵以及巴黎的埃菲尔铁塔都符合黄金分割规律。同时,在自然界中,许多美的事物也处处体现了黄金分割规律。因此,黄金分割被认为是一种极为合理的现象。C60的分子结构恰恰也符合黄金分割规律,说明C60在对称性上占有了一定的地位。
5.无处不在的C60
合理的必然是永存的,从这个意义上说,具有高度对称性的C60将是无处不在的。事实上,只要你稍加留心,便会发现自古至今,世界上存在许许多多的C60,但它们并非克罗托和斯莫利发现的C60。
意大利文艺复兴时期的画家达·芬奇曾经画了一幅画,表达了一个空心的平截二十面体的网络结构,令人惊奇的是.图中的网络结构竟然与克罗托等人设计的C60分子结构相似到了一模一样的程度。
达·芬奇是15~16世纪的画家,距今已经几百年了,但是他却能构思出这幅C60的图画,说明C60确实是一种完美的概念。众所周知,达·芬奇不但是一位著名的画家,他还是一位科学家,从这个意义上讲,也许早在几百年以前,达·芬奇的脑子里就存在着一个C60分子了。可惜的是,达·芬奇的画并没有对克罗托和斯莫利有所启迪。
值得骄傲的是,中国也早已有了C60结构的作品,那就是中国的狮子雕塑,它们的作用是重要建筑物门前的警卫。在北京紫禁城内乾清官的大门前就有这样的一对狮子雕塑作为警卫,它们的时间可以追溯到清乾隆年间(公元1736年~1796年)。
在乾清宫门前的雄狮的右爪下有一个球,球的表面分散着五边形和六边形的雕饰图案,当你仔细观察时,你同样会发现,这个小球也是一个C60分子。
同样遗憾的是乾清官狮子爪下的球也没有被克罗托和斯莫利参观过,否则的话,今天的C60就不会被命名为“富勒烯”,而要称为“狮子球烯”了。
6.富勒烯家族的成员
在富勒烯家族中,除了最重要的C60外,居于第二位的乃是C70,它的分子不是球形,而是酷似一只橄榄球。C70是红色晶体,室温下以面心立方晶体存在。
在C60分子中,所有碳原子所处的位置都是等同的,而在C70分子中,碳原子所处的位置并不都相同,原子之间的距离ab≠bc≠cd≠de,因此,在C70分子中,存在着5种类型的碳原子。
现在,属于富勒烯家族的碳原子簇都是由偶数个碳原子构成的,已经有C20、C32、C40、C50、C60、C70、C240、C540、C960。
三.球碳的特性和潜在应用前景
由于晶态的C60是一种分子之间靠范德华力吸引的固体,因此,不仅能在C60的分子笼内装入或在分子表面镶嵌其他原子或原子团,而且还可以通过向C60晶体的面心立方晶格的间隙位置掺人其他原子,形成掺杂的C60化合物。
X射线衍射实验表明,C60晶体的面心立方点阵形成了正八面体和正四面体空隙,空隙中可以填人其他原子或原子团,如果在空隙位置上掺人Ax原子,即形成了AxC60化合物。
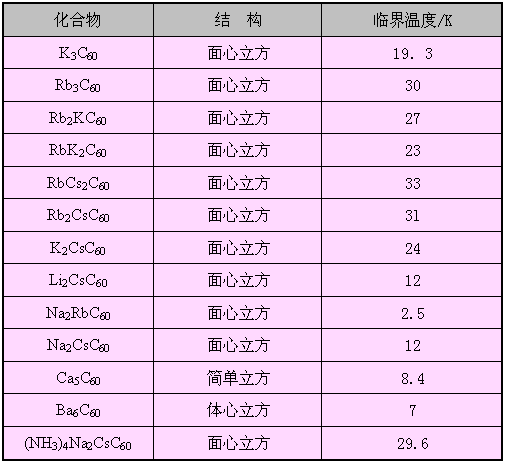
1.超导新星
掺杂C60化合物的最重要和最令人感兴趣的性质是超导性。最先采用的掺杂元素是碱金属,可用碱金属的蒸气与C60固体直接反应,生成碱金属掺杂C60化合物。
因为C60具有强烈得到电子的倾向.碱金属则容易失去电子,因此,碱金属原子可以作为“施主”型杂质掺入C60中。在碱金属掺杂C60化合物中,碱金属原子占据了C60面心立方晶格中的四面体和八面体中的空隙位置。
掺杂C60化合物的临界温度已经有了不小的提高,已经超过所有的有机化合物超导体。值得——提的是当今研究的最广泛和临温度最高的镧铜钡氧化物超导体是一种二维超导体,是把两块半体的中间夹一薄层金属氧化物的夹心面包式超导体。而碱金属掺C60化合物则是一种三维超导体,它的优点是各向同性(即在三维空间的各个方向上的性质都是一样的),它的电流密度大,稳定性高,容易加工成线形材料,因此,显示出了作为实用化超导材料的潜在应用前景。
掺杂C60化合物超导体的结构和临界温度
2.巧夺天工的功能材料
材料科学是20世纪蓬勃发展的一种科学技术,其中最令人注目的要算功能材料。“功能”一词指事物所能发挥的有利的作用和效能,功能材料则是利用它的物理和化学的特殊性能来发挥它的记忆功能、感觉功能、催化活性、生理机能、药理性能、光敏性、导电性等。
曾经有人羡慕鱼类的功能,也想能够生活在海里,尽情地欣赏美丽的海底世界,于是,他们设想用一种功能材料模仿鱼类的呼吸器官,制成人工鳃,人们戴上这种人工鳃,便能够长时间在水里生活,上述情况便是对功能材料最形象的描述。
(1)气体的贮存
20世纪末,掀起了研制以氢气做燃料的汽车,其原因在于:与汽油、煤油、柴油等作为机动车的燃料相比,氢气在发动机内燃烧以后,产生的是水蒸气,它无毒,因此氢气被认为是一种无、污染的燃料。
用氢气做燃料要解决它的贮存问题,现在,贮存氢气的方法主要有三种:第一种是将氢气压缩在钢瓶中使用;第二种是在低温下将氢气液化,贮存在耐压容器中;第三种是用贮氢材料吸附氢气后进行贮存,其中以第三种方法的效果最好。
在加压的情况下,氢气能被诸如钛、锰、镍、铁、稀土等金属及其合金吸收,就像海绵吸水一样,使氢气被金属固体吸收而贮存起来。在需要使用氢气时,只要减压,氢气便能从贮氢材料中释放出来。
利用C60独特的分子结构,可以将C60用作比金属及其合金更为有效和新型的吸氢材料。每一个C60分子中存在着30个碳—碳双键,因此,把C60分子中的双键打开便能吸收氢气。现在已知的C60的稳定的氢化物有C60H24,C60H36和C60H48。
在控制温度和压力的条件下,可以简单地用C60和氢气制成C60的氢化物,它在常温下非常稳定,而在80℃~215℃时,C60的氢化物便释放出氢气,留下纯的C60,它可以被100%地回收,并被用来重新制备C60的氢化物。与金属或其合金的贮氢材料相比,用C60贮存氢气具有价格较低的优点,而且C60比金属及其合金要轻,因此,相同重量的材料,C60所贮存的氢气比金属或其合金要多。
C60。不但可以贮存氢气,还可以用来贮存氧气。传统的贮存氧气的方法除了用高压气瓶之外,还可以利用吸附剂(如活性炭、沸石或分子筛)来吸收氧气进行贮存。如果用C60作吸附剂,其效果将好于活性炭、沸石或分子筛,例如,活性炭贮存氧气的密度只有0.3 g/cm3—0.7 g/cm3,而C60贮存氧气的密度可达1.5 g/cm3。与高压钢瓶贮氧相比,高压钢瓶的压力为3.9X106Pa,属于高压贮氧法,而C60贮氧的压力只有2.3X105Pa,属于低压贮氧法。利用C60在低压下大量贮存氧气对于医疗部门、军事部门乃至商业部门都会有很多用处,现在已经研制出手提式氧气贮存和发生装置。
(2) 有感觉功能的传感器
传感器能够将感受到的物理量或化学量等信息按一定的规律转换成便于测量和传输的信号,这些被感觉到了的信号便是人们用来控制仪器或仪表的装置。由于电信号最易于传输和处理,所以大多数的传感器都是将信息转换成电信号输出的,例如传声器就是一种传感器,它能感受声音,转换成相应的电信号,再把电信号传输给扩音器,使声音传输到其他地方。
现在,C60也被用来制造传感器,由于用C60薄膜做基质材料可以制成手指状组合型的电容器,用它来制成的化学传感器具有比传统的传感器尺寸小、简单、可再生和价格低等优点,可能成为传感器中颇具吸引力的一种候选产品。化学传感器在接受有害化合物产生的信息后,便按有害化合物量的多少传输出电信号,便可测得这些有害物质的量,例如在天然气净化、石油炼制、煤气生产、制革、制药、造纸和合成纤维的生产过程中都会产生硫化氢气体,也是造成大气污染的主要气体。利用C60薄膜为基质制成电容器,进一步制成传感器,能够检测出大气中体积分数小于百万分之一的硫化氢。又如异丙醇是造成水质污染的重要原因之一,化学传感器可检测出溶解在水中体积分数低到1/25000 的异丙醇。
(3) 增强金属
提高金属材料的强度可以通过合金化、塑性变形和热处理等手段,强化的途径之一是通过几何交互作用,例如将焦炭中的碳分散在金属中,碳与金属在晶格中相互交换位置,可以引起金属的塑性变形,碳与金属形成碳化物颗粒,都能使金属增强。
在增强金属材料方面,C60。的作用将比焦炭中的碳更好,这是因为C60比碳的颗粒更小,活性更高,C60与金属作用产生的碳化物分散体的颗粒大小是o.7nm,而碳与金属作用产生的碳化物分散体的颗粒大小为lpm~5pm,在增强金属的作用上有较大差别。
(4) 新型催化剂
多数具有工业意义的化学转化过程,例如石油炼制、石油化工以及塑料、合成纤维、合成橡胶三大合成材料工业的转化过程都是在催化剂的存在和作用下进行的。
铂系金属是较早使用的一种高效催化剂,虽然因为它们的原料来源稀缺、价格昂贵,但现在仍有一些工业(如石油的催化重整以制造高质量的汽油)仍必须采用铂做催化剂。镍这种金属也是一种常用的催化剂,例如有机化合物(如油脂)的加氢工业。
基于这些前提,在发现C60以后,化学家们开始探讨C60用于催化剂的可能性。C60具有烯烃的电子结构,可以与过渡金属(如铂系金属和镍)形成一系列络合物,例如C60与铂、锇可以结合成{[(C2H5)3P]2Pt}C60和C60OsO4·(四特丁基吡啶)这些配位化合物,有可能成为高效的催化剂。
日本丰桥科技大学的研究人员合成了具有高度催化活性的钯与C60的化合物C60Pd6。中国武汉大学研究人员合成了Pt(PPh3)2C60(PPh3为三苯基膦),对于硅氢加成反应具有很高的催化活性。
C60还有一个特性,就是它可以通过接受和给予电子发生氧化还原反应,在C60分子上连接钕、铝和氯原子,便构成了一个能引发丁二烯聚合的“微观分子反应器”,使丁二烯在“微观分子反应器”上发生催化聚合反应,以制造合成橡胶和合成树脂。
(5) 光学应用
具有独特微观结构的C60具有特殊的光学性质,其中令人感兴趣的光学性质之一是光限制性,即在增加入射光的强度时,C60会使光学材料的传输性能降低。
光限制性在眼对强光源的防护上具有重要意义。以C60的光学限制性为基础,可研制出光限制产品,它只允许在敏化阈值以下(即对眼的危险阈值以下)的光通过,这样就起到了保护人眼免受强光损伤的作用。
(6) 癌细胞的杀伤效应
C60经光激发后有很高的单线态氧的产率,而单线态氧与生物机体的生理生化功能、组织损伤、肿瘤以及光化治疗技术都有着重要关系。
当对C60的激发光强度达到4000 lx (x是光照度的单位勒克斯的符号)时,癌细胞受单线态氧的作用已接近100%死亡,能有效地破坏癌细胞的质膜和细胞内的线粒体中质网和核膜等重要的癌细胞结构,从而导致癌细胞的损伤乃至死亡。
还有的研究报导指出,可以将肿瘤细胞的抗体附着在C60分子上,然后将带有抗体的C60分子引向肿瘤,也可以达到杀伤肿瘤细胞的目的。
(7) 其他医疗功能
C60的衍生物具有抑制人体免疫缺损蛋白酶的活性的功能。人体免疫缺损蛋白酶是一种导致艾滋病的病毒,因此,C60的衍生物有可能在防治艾滋病的研究上发挥作用。
C60还适宜于在生物系统中充当自由基清除剂和水溶性抗氧剂,自由基是导致某些疾病甚至肿瘤的有害物质,C60可望能够降低患病者血液中自由基的浓度,还可抑制畸形的和患病细胞的生长。
在介绍完了有关富勒烯的全部材料之后,应该指出,化学家的任务是在认识一个现有的世界的基础上来改造和利用这个现有的世界,但是仅仅有这一点还是很不够的,化学家的最终目的还要用新的化学理论和先进的实验手段创造一个新世界,利用人工合成的方法创造新物质,让人类走向“人工合成”的新时代。
也许,被埋没了一个多世纪的C60的发现会在创造这个新世界中起到应有的作用,而正是因为克罗托、斯莫利和科尔弥补了化学发展中的这一重大遗漏,才会受到全世界科技界的赞扬。因此,在人类创造这个新世界的过程中,应该多出现几个像克罗托、斯莫利和科尔一样的科学家,应该多发现一些像C60这样被埋没了多年的珍宝。
|