|
二、 化学与物理学的研究对象和研究内容之比较
从上面所介绍的化学学科的理论基本特征就可以看出化学与物理学在研究对象和内容上的异同。我们知道物理学是研究物质在四种相互作用(引力作用,电磁作用,弱相互作用和强相互作用)下形成的组成,结构即其变化规律的科学。两者都要研究物质的组成,结构及其变化规律,这是它们的共同点,但两者又有很大的不同。事实上,通常的化学(除了核化学和高能化学外)只从原子,分子的角度研究物质的组成,结构和结构变化规律。而物理学不仅要研究原子,分子在电磁作用下所形成的结构及其变化,而且还要研究由原子,分子所组成的宏观客体在电磁作用下的运动,变化规律,此外还要研究物质在其他三种作用(引力作用,弱相互作用和强相互作用)下形成的物质结构,物质运动和变化规律。物理学一方面要探索在四种基本作用下,宏观物质和微观物质的运动和变化的基本规律,如经典场论和量子力学。另一方面,还要探索宏观和微观间的相互联系的规律,即物质的宏观规律,如热力学和统计物理。化学则以反应论为中心,从研究原子,分子在电磁场作用下引起的各种反应变化规律出发,以阐明所产生的微观组成和结构,进而认识物质的宏观状态和性质。由此可见,化学是在原子,分子层次内应用物理学电磁作用的基本规律来建立化学的反应理论。在这里化学必然要以物理学的微观理论——量子理论和物质的宏观理论——热力学,统计物理为基础。同时,正由于化学是以其反应论为中心,这就必然使它具有区别于物理学的特殊性。这种特殊性表现在以下几个方面:1,化学具有自身的特殊表现形式,如元素符号,化学分子式,化学反应方程式,以及高分子结构拓扑式等。2,化学在物理理论基础上建立了一系列的表征化学反应过程的特殊规律,如质量作用定律;浓度与电极电位关系的能斯特方程;表征过度态反应速度常数的艾林公式;关于溶质与溶剂的拉乌特(F.M.Raoult)定律;元素周期律,以及表征化学过程自发反应方向的吉布斯判据等。3,在物理理论的基础上创立了各种化学理论,如反应动力学中过度态理论,结构化学中的价键理论,晶体场理论,分子轨道理论,以及高分子的构象理论等。
至此我们已经看到化学不仅与物理学有共同的对象,或共同的研究特点,它们都是研究物质的组成,结构和组成,结构的变化规律的科学。但化学又有它自身的特殊性,这种特殊性显示了化学反应论在研究方法上和具体内容上有别于物理学的诸多特点。同时,我们还应当看到,化学学科的理论既是物理学基础理论在化学领域中应用的结果,同时,它的理论结果和研究方法又是对物理理论的丰富和发展。例如,元素周期律是化学中极为重要的规律,它反映了化学元素性质随原子序数周期变化的规律性。而量子理论却为揭示元素周期律的本质建立了坚实的理论基础。从这里我们又看到了物理与化学的联系与区别。化学是以元素周期律作为它全部理论的基础之一,是它立论的一块基石。而物理则是以探索,揭示物质变化中存在元素周期性的本质为己任,研究为什么元素性质会周期性地变化。又如结构化学中的晶体场理论正是量子力学中粒子系的简并态(或简并能级)在外场作用下消除简并理论的具体应用,只不过这时消除简并的外场是由配体离子的各种配合布列产生的。而核化学则正是将化学反应的方法论应用于核物理的核子的反应和转化所得到的结果。还有物理学中描述相变的Ising模型理论中有一个化学近似法,这个方法是化学反应方法论在物理学中的典型应用。这个近似法是将格点上的自旋取向体系视为三种配对组分的混合体,即(↑↑),(↓↓)和(↑↓),这三种组分的配对数分别是 N++,N--和N+-。同时三种组分满足以下的反应方程:
(↑↑)+(↓↓)=2(↑↓) (3.1)
由此可以建立临界点上的质量作用方程:
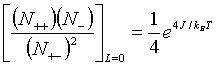 (3.2)
(3.2)
式中J是自旋配对偶合能,kB是玻尔兹曼常数,T是绝对温度,L是表征有序化的序参量,这里L=0表示临界点上由有序转入无序条件。(3.2)式的右端就是(3.1)式反应的平衡常数(或反应速率常数)。可以看出当J=0时,式(3.2)右端等于
1/4,这时自旋体系的平行和反平行配对是等几率的。而且可以证明当J>0 和J<0 时,自旋体系中平行和反平配对不在是等几率的了。J>0
时,自旋平行超过反平行;J<0 时,自旋反平行超过平行。这时自旋系统分别进入铁磁相和反铁磁相中。
|