|
四.物理学微观理论对化学的指导作用
[案例20] 返回
物理学的微观理论—量子理论和量子统计及方法为化学学科的微观理论奠定了理论基础。同时,化学学科微观理论的发展又从内容和方法上极大的丰富了物理学的微观理论。下面以结构化学和量子化学两门基础学科来了解在微观理论方面物理与化学之间的紧密关系。
(一)结构化学
在19世纪末至20世纪初叶由“紫外灾难”引起的人类对物质结构认识的变革中,相继有普朗克,爱因斯坦,玻尔,德?布罗意,薛定谔和海森堡等人的创造性工作,建立了量子理论。从此,人类对物质微观结构的认识就有了可靠而有效的理论基础,使19世纪末在旧的经典理论基础上建立的“物质结构”理论进一步在量子理论基础上有了一个质的飞跃。物质结构(结构化学)理论在其发展过程中主要沿着两条途径发展:其一,以演绎分析方法为主,即根据微观粒子运动的普适规律—量子力学,研究原子中电子在核和其他电子作用下的运动规律,由此探寻原子的性质,尤其要定量地阐明化学元素在周期表中性质的周期性。在量子力学基础上揭示并表征原子间,原子分子间各类化学键的本质,进而阐明原子如何形成分子,原子,分子又如何组成晶体。此外,结构化学还有一个很重要的任务就是在含时的量子理论基础上研究化学反应过程中,电子的运动状态和分布如何在原子,分子参与反应的过程中的变化规律。这是结构化学发展的第一条途径。结构化学发展的第二条途径是以综合归纳为主的方法,主要是依据一些物理的,化学的测试手段,如高纯度提纯手段,分离手段,X-射线技术,原子光谱和分子光谱技术,以及核磁共振和电子自转共振技术等,以此来研究纯物质内部原子的排列和运动,原子中电子的状态和能谱,并籍助量子力学理论对所测量结果进行综合分析,从中归纳出有关物质结构及其变化的规律。
在上述的两条途径的第一条途径中,还发展了一类用一定模型假设,直接通过求解量子力学薛定谔方程,从中得到原子,分子系统内电子运动,核运动以及它们之间相互作用的结构图像,并将这些图像与各种光谱测量结果进行比较,以总结出化学的各种基元反应规律。沿这条途径发展成为与结构化学独立的另一个分支学科——量子化学。沿第二条途径着重在测试技术的分析上发展,逐渐形成“光谱分析”和“X-射线谱分析”两个分支学科。
结构化学以阐明物质的各种宏观化学性质(如化学反应性能,化学性能稳定性等)和各种非化学性能(如各种物理的,生物的性能)与其微观结构之间的关系和规律性。它所依据的理论基础是量子力学。它依据的实验手段是各种近代的测试原子,分子状态极其转变的各种分析谱仪(如各种光谱仪,X-射线仪,中子衍射仪,电子衍射仪,拉曼谱仪和穆斯堡尔谱仪等),用这种近代测试手段探测原子,分子静态和动态的结构与性能,进而以量子力学为基础对测试的结果,尤其是其中规律性结果进行理论分析,以阐明原子如何按确定的量结合成确定的分子;阐明原子在分子中相互作用的各种形式,以及原子在分子中排布的空间几何拓扑结构;阐明原子或原子基团在其微观环境中的价态,电子组态,配位结构和功能特性。结构化学还有一个极为重要的研究领域,那就是有机高分子构象的研究领域。由于巨型高分子和小分子有很大的差别,在小分子中量子力学规律起绝对的支配作用,因此对小分子研究在理论上必然以量子力学为基础。但是对于巨型高分子情况就大不相同了,在这里虽然支配高分子中每一个单体仍然是“较好的”量子体系,而对由大量单体组合成的分子链(当然这些高分子链可以是线性链,也可以是非线性链,可以是单链,也可以是多连通的复链)而言,其遵循的规律主要是统计规律。因此,结构化学中对有机高分子的研究一方面要以量子理论研究它的单体所处的状态和结构,同时还必须以统计物理理论研究高分子的整体空间构象。这一领域由P.J.弗洛日(Flory)领导的小组的出色的工作,已为高分子构象的统计理论建立了一个较好的基础。
特别令人鼓舞的是结构化学在蛋白质,核酸,胰岛素等晶态大分子的研究中所取得的可喜成就,为生命科学的发展作出了重要贡献。1930年前后,英国科学家贝尔纳(J.D.Dernal,1901~1971)利用X-射线衍射法发现了蛋白质的折叠卷曲状结构。1951年鲍林又发现了蛋白质的α螺旋结构,从而研究生物大分子结构的基础。1956年英国化学家桑格(F.Sanger,1918~)测定了最简单的蛋白质牛胰岛素的结构,确定了蛋白质中氨基酸的结合顺序,为人工合成胰岛素提供了设计蓝图。我国科学工作者经过7年的通力合作,于1965年9月首次人工合成了结晶牛胰岛素,1971年又完成了分辨率为2.5埃和1.8埃的胰岛素晶体结构测定工作。这一工作开创了人工合成蛋白质的新阶段,是继19世纪人工合成尿素之后所取得的又一大突破。
在核酸研究方面,1953年美国生物化学家沃森(J.D.Watson,1928~)和英国物理学家克里克(F.H.Crick,1916~)根据X-射线的衍射数据,提出了脱氧核糖核酸(DNA)分子的双螺旋结构,从而在分子水平上合理的解释了生物遗传机制,开辟了分子生物学的新纪元,在揭示生命奥秘的科学征途中迈出了重要的一步。
(二)量子化学
量子化学,如上所述它是从物质结构理论中独立发展的一个新的学科分支。量子化学首先对所研究的原子,分子系统提出一定的近似模型假设,例如电子运动与核运动分离的近似假定,又称玻恩-傲本海默近似,即假定电子进行快运动,而核进行慢运动,这两种运动是独立的。进一步还可以假设核静止不动,只有电子在原子,分子中运动,这种近似称为哈特利-福克近似。每一个近似的模型假设就有其相应的哈密顿H,由此可以建立相应系统的薛定谔方程。第二步求解薛定谔方程,以得到原子,分子中的电子运动或电子密度分布;核的运动以及电子—核,核—核之间的相互作用图像。第三步将所得的解的图像用以阐明光谱,波谱和电子能谱的实验谱图,两者若相合则证明理论模型是恰当的,否则表明理论模型有问题,必须修改。对于已被大量原子,分子系统确证的有效的近似模型,从它的解中可以总结出各类基元反应的规律,预测原子,分子的稳定性以及它们的反应活性。
量子化学是在1925—1927年开始创立的,首先由哈特利和伦敦运用哈特利—福克近似模型建立的氢分子系统的薛定谔方程,成功地建立了由两个氢原子结合成为一个氢分子的共价键理论,并算出的结合能与实测的结合能较好的符合。由此,化学家们认识到量子力学原理对分析原子,分子系统的作用,从此在物质结构学科中逐渐形成了独立的量子化学这个学科分支。
量子化学建立后,在发展中逐渐形成了三种较成熟的理论系统,这就是1.价键理论。2. 分子轨道理论。3.配位场理论。下面简略地介绍这三种理论,其中以双原子分子为例着重介绍共价键的形成。
1. 价键理论
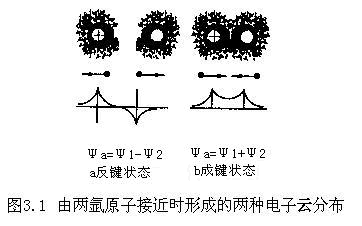
价键理论最初由美国的刘易斯(1916年)对氢分子形成提出了两氢原子共享其一对电子而结合在一起的设想,当时刘易斯只是一个设想,并没有对这个设想进行严格证明。到了1927年,海特勒和伦敦将量子力学应用于氢分子(H2)的形成,才使刘易斯共价键的设想得到严格的理论证明。后来鲍林将海勒特,伦敦关于氢分子的共价键的理论成功的推广到似氢离子和一些简单的双原子分子的形成上,并得到与实验一致的结果这样才正式建立共价键理论。事实上,当两种原子对其外层价电子的作用是相似时,两原子接近其外层电子云彼此交叠,这种交叠可以形成两种对成的电子云交叠结构,一种是电子自旋平行配对结构,另一种是电子自旋反平行配对结构。电子处于自旋平行配对结构时电子间不仅有静电斥力,而且还有泡力斥力,因此,两原子的电子云在这种斥力作用下分布于两原子核外端,如图3.1a所示。而电子处于反平行配对时,这时虽然电子间仍具有静电斥力。但是,一方面泡利原理允许两反平行电子可以进入同一电子轨道,另一方面两电子在交叠中进入的同一轨道是两原子接近时能量最有利的状态。这种情况下两原子的电子云必然自动的分布于两原子核之间以实现最低能量的对称态。如图3.1b所示。可以想见,当两个原子处于电子自旋平行时,由与电子云分布于两原子实的外端,两原子实之间必产生很强的斥力,导致两原子分离,不肯恩格形成双原子分子。人们把自旋平行时的电子分布状态称为反键状态对于自旋反平行配对情况,由与电子云集中分布于两原子实之间,这是原子实间的高密度电子云恰等价于在两带正电的原子实之间架起一座属于两原子共有的有电子云形成的负电心吸引桥,这个吸引侨大大的降低了两原子系统的能量,形成了所谓的共价键。形成共价键的电子状态称为成键状态。共价键理论能很好的分析相同原子或元素性质相近的双原子分子的形成,初步揭示了自由电子由电子共有化形成共价键的本质。但是这个共价键理论很难说明共价键的方向性,而且也解释不了单电子键(如H2+)的存在,以及氧分子具有磁性等问题。例如对O2分子,按每个原子有两个未配对的电子,则两个氧原子的2PX电子配对可以形成δ键,两个2PX电子配对可以形成π键,于是O2分子应构成双键,而且价键是饱和的不应就有磁性,即O2分子应具有O=O结构。可是实验中给出的O2分子是顺磁型分子,表明O2分子必然还存在未配对电子,只由这样才使O2分子具有磁性。1932年由美国的密立根和德国的洪德提出分子轨道理论后,共键键理论得到了新的发展。结合分子轨道论的共价键理论就形成了现代共价键力路,现代共价键理论具有三个要点:
(1)自旋相反的单电子相互接近时,核间电子云密度较大时结构的稳定态,可以形成稳定的化学键。
(2)共价键有饱和性。按泡利不相容原理,已键合的电子不能再形成新键即电子配对成键有饱和性。如H原子的电子与另一H原子的电子配对后形成
H2,则 H2就不能再与第三个H的电子键形成H3。
(3)共价键有方向性。根据电子轨道最大重叠原则,再形成共价键是,原子间总是尽可能的沿着电子轨道在最大重叠的方向上成键。
2.分子轨道理论
几乎与价键理论同时发展起来的还有另一种共价键理论-分子轨道理论。该理论是美国化学家马利肯(R.S.Muliken,1896~1986)与德国化学家洪德(F.H.Hund,1896~?)于1930年前后提出的。与价键理论不同的是,分子轨道林论着眼于分子的整体性,把分子作为一个整体来处理。这一理论认为,能量相近的原子轨道可以组合成分子轨道,组合时轨道的数目不变,但轨道的能量发生了变化。按照分子轨道的能量大小,可以排列出分子轨道的近似能级图。分子中的电子都在一定能级的分子轨道上运动,就象原子中电子在原子轨道上运动一样,分子的能量等于分子中电子能量的总和。电子轨道的组合不是任意的,而必须遵循能量近似原则,对称性原则和最大重叠原则。分子轨道理论较全面地反映了分子内部电子的各种运动状态,并能成功地解释分子中电子对键,单电子键,三电子键的形成,对多原子分子的结构也能给予较好地说明,成功地解决了一些较复杂分子的结构分析,例如甲烷分子的成键问题。实际上,实验指出甲烷是正四面体结构,有四个
C—H 等价键(键角均为109°28'),而碳原子基组态为 通过环境微拢激发到近邻的价态
通过环境微拢激发到近邻的价态 ,
,
即:C(基态)
 (3.4) (3.4)
这样碳原子就由二价原子转变为四价原子,解释了甲烷的分子结构问题。
3.配位场理论
1893年瑞士的维尔纳最早提出了配位场理论初步模型,他的理论模型有以下三个要点:(1)认为金属原子络合物除主价外还有副价,元素既要满足主价要求,又要满足副价要求,例如CoCl3·4NH3钴的主价为3,副价为4,因此能与三个氯原子结合的同时,又与四个NH3结合。(2)络合物键分“内界”和“外界”。内界由中央离子与周围原子紧密结合,很难离解。(3)副价易显示空间的方向性,使络合物易形成异构。
维尔纳虽初步提出了配位理论,但这个理论多半还是一种模型假定,理论中许多概念尚是模糊的。1929年贝特为结实过度金属能谱分裂现象,以量子理论为基础提出配位场,后来这个理论又结合分子轨道理论,使之发展成为现代配位场论。现代配位场论是三大基础理论综合,即(1)价键理论(主要是电价配键和工价配键理论)。(2)晶体场论,确认络合物中心离子与配体之间的配键为共价形式,对此最有效的理论方法是分子轨道理论。
总之,从结构化学和力量子化学的建立和发展可以清楚地看出化学学科微观理论的第一基础是物理学的量子理论,其次是统计理论。同时,结构化学和量子化学的发展又对量子理论内容的充实和方法论的扩展起着重要的反作用。化学中的微观理论,尤其量子化学是物理学的量子理论在化学中最有效地应用的结果,它所发展的一整套方法:价键理论,分子轨道理论,配位场理论等等都是对量子力学近似方法的补充。而结构化学和量子化学中那些已被大量实验证实的诸多的理论和方法也都是对物理学量子理论和统计理论的证实和完善。
|